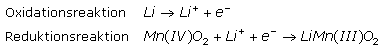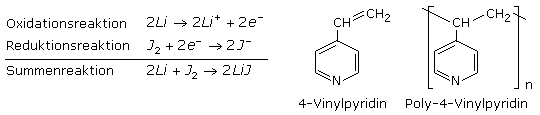Galvanische Zellen – Primärzellen
Auf dieser Seite werden die vereinfachten Redoxreaktionen und der prinzipielle Aufbau alter und neuerer Primärzellen beschrieben. Es gibt Informationen für folgende Primärelemente: Daniell-Element, Lechlanché Nasszelle, Zink-Chlorid-Element, Zink-Braunstein Trockenbatterie, Alkali-Mangan-Element, Zink-Silberoxid-Element, Li-MnO2-Zelle, Li-SOCL2-Zelle, Li-FeS2-Zelle und Li-Jodid-Zelle.
Elektrischer Strom kann nicht wirklich dauerhaft gespeichert werden. Meistens wird er im Kraftwerk durch Umwandeln anderer Energieformen erzeugt und dem Nutzer direkt zur Verfügung gestellt. Elektrische Energie kann mit nicht allzu hohem Wirkungsgrad in Kondensatoren zwischengespeichert werden. Kleinere Elektrizitätsmengen sind in Batterien und Akkumulatoren in Form chemischer Energie speicherbar, die bei Bedarf in elektrische Energie umgewandelt wird.
Zwei unterschiedliche Metalle, die mit einem sauren oder alkalischen Elektrolyten chemisch reagieren können, erzeugen elektrische Potenziale. Zwischen den Metallen ist eine elektrische Spannung messbar, die bei geschlossenem Stromkreis einen elektrischen Strom fließen lässt. Das System liefert solange elektrische Energie bis die Metallelektroden aufgelöst oder der Elektrolyt chemisch inaktiv geworden, umgangssprachlich verbraucht ist.
Primäre elektrochemische Zelle
Die Voltasche Säule als erste Batterie bestand aus Kupfer und Zinkscheiben mit dazwischen liegenden Filzscheiben, die mit einer Salzlösung getränkt waren. Bei diesem elektrochemischen System verläuft der Vorgang in einer Richtung und stellt elektrische Energie bis zum Ende der chemischen Reaktionen bereit. Diese Anordnung ist eine nicht reversible elektrochemische Zelle und wird als Primärzelle bezeichnet.
Archäologische Ausgrabungen brachten als 'Bagdad Batterie' beschriebene Funde zutage, die als elektrochemische Zelle gedeutet werden können. In einem Tongefäß befindet sich ein Kupferblechzylinder, der einen dazu isoliert stehenden Eisenstab umgibt. Der Stab reicht durch einen Bitumenverschluss nach außen. Füllt man das Gefäß mit Essigwasser, saurem Wein oder Zitronensaft und stellt auch zum Kupferzylinder eine elektrisch leitende Verbindung her, so ist eine geringe Spannung von rund 0,75 V messbar.
Primärzellen sollten weder mit Ladegeräten verbunden, noch kurzgeschlossen oder erhitzt werden. Sie sollten auch nicht ins Wasser gelangen oder lange Zeit ungeschützt in sehr trockenen Räumen gelagert werden, es sei denn, sie sind wasserdicht verpackt. Beim Auswechseln sind immer alle Batterien oder Zellen durch geeignete gleiche Chargen desselben Herstellers zu erneuern.
Sekundäre elektrochemische Zellen
Sehr bald wurden reversibel arbeitende elektrochemische Zellen entwickelt, es sind die Akkumulatoren oder Akkus. Am bekanntesten ist der Blei-Akku, ein System aus Blei, Schwefelsäure und Bleidioxid. Die geladene Zelle gibt elektrische Energie ab. Nach Ablauf der chemischen Reaktion kann durch Zufuhr elektrischer Energie der chemische Prozess umgekehrt werden. Beim Ladevorgang wird die elektrische Energie wieder in die anfängliche chemische Energie überführt und kann erneut elektrische Energie liefern.
Akkus sollten keinem Kurzschluss, keiner Tiefentladung oder Überladung ausgesetzt werden. Beim Aufladen sind die Richtlinien der Hersteller zu beachten. Es gibt spezielle Ladeerhaltungsschaltungen, die im Dauerbetrieb einem Akku keinen Schaden bereiten.
Unterschied zwischen galvanischer Zelle und Batterie
Die galvanische Zelle ist die kleinste Baueinheit einer Batterie. Batterien sind Zusammenschaltungen in Form von Reihen- oder Parallelschaltungen mehrerer Zellen. Im allgemeinen Sprachgebrauch werden sie alle als Batterie bezeichnet. Die elektrische Energie wird durch chemische Reduktions- und Oxidationsreaktionen erzeugt. An den Elektroden entstehen Einzelpotenziale. Zwischen beiden Elektroden ist als Potenzialdifferenz die Zellen- oder Batteriespannung messbar. Das chemische System befindet sich bei offenem Stromkreis im chemischen Gleichgewicht zwischen den beiden Elektroden und dem Elektrolyten.
Bei geschlossenem Stromkreis laufen in der Zelle kontinuierlich chemische Reaktionen ab, wobei die Zellenspannung weitgehend aufrechterhalten bleibt. Die Spannung treibt im äußeren Stromkreis einen elektrischen Strom aus Elektronen. In der Elektrolytlösung der Zelle wird der Stromfluss durch wandernde positive und negative Ionen aufrechterhalten.
Unterschiede zwischen Primär- und Sekundärbatterien
- Primärzellen
- Primärzellen haben die größere Energiedichte bezogen auf die gleiche Volumen- oder Gewichtseinheit. Eine Ausnahme machen die Li-Ionen Akkus. Primärzellen haben eine geringe Selbstentladungsrate zwischen 2 ... 5 % pro Jahr, bei Li-Braunstein Feststoffzellen nur 1 % pro Jahr. Der Innenwiderstand der Zelle erhöht sich mit der Zeit selbstständig, wodurch die Belastbarkeit abnimmt.
- Sekundärzellen
- Sekundärzellen zeichnen sich durch die höhere Belastbarkeit aus. Ihre flüssigen Elektrolyten erlauben mit der besseren Beweglichkeit der Ionen schneller ablaufende chemische Redoxreaktionen. Diese Zellen haben vielfach sehr hohe Selbstentladungsraten zwischen 10 ... 25 % pro Monat. Der Innenwiderstand der Zellen ist sehr klein und meistens langzeitstabil.
Galvanische Zellen
Galvanische Halbzellen
Taucht eine Zink-Metallelektrode in verdünnte Schwefelsäure ein, so werden neutrale Zinkatome oxidiert und gehen als positive Zinkionen in die Lösung. Die Oxidationsreaktion läuft freiwillig ab und wird als anodische Oxidation bezeichnet. Die Zinkelektrode ist die Anode und bildet den Minuspol, da sie sich mit den aus dem Zink frei werdenden Elektronen negativ auflädt. Sie soll elektrisch leitend mit einer zweiten Elektrode verbunden werden, die ebenfalls in den Elektrolyten eintaucht aber chemisch nicht mit ihm reagiert. Diese reaktionsträge Elektrode kann ein Graphitstab oder Platindraht sein. Sie erhält die negativen Ladungen als Elektronenstrom von der Zinkelektrode und zieht als Kathode positive Hydroniumionen aus dem Elektrolyten an. Die Wasserstoffionen nehmen Elektronen aus der Kathode auf und werden zum neutralen Wasserstoff reduziert. Der molekulare Wasserstoff steigt an der Elektrode als Gasbläschen auf. Ohne diese zweite galvanische Halbzelle mit der reaktionsträgen Kathode geht das Zink ebenfalls oxidativ in Lösung. Die Entwicklung von Wasserstoffgas findet dann direkt an der Zinkelektrode statt.
Das Zusammenschalten von zwei Elektrodensystemen mit unterschiedlichen elektrochemischen Potenzialen entsteht eine galvanische Kette oder galvanisches Element. Diese Anordnung speichert chemische Energie und dient als Gleichspannungsquelle. Werden die Elektroden durch einen äußeren Stromkreis elektrisch leitend verbunden, so liefert die Zelle elektrische Energie. Sie kann solange entnommen werden, bis die freiwillig ablaufende chemische Reaktion in mindestens einer der Halbzellen durch Substanzverbrauch zum Stillstand kommt. In einer aufgebrauchten Primärzelle ist die chemische Reaktion nicht umkehrbar. Entweder hat sich das Elektrodenmaterial aufgelöst oder der Elektrolyt wurde durch die Gasentwicklung verändert.
Daniell-Element
Eine praktische Anwendung, es sei denn als Lehrmodell im Chemieunterricht, gibt es für diese Nasszelle nicht mehr. Die eine Halbzelle besteht aus einer Zinkelektrode in Zinksulfatlösung. Die zweite Halbzelle ist eine in Kupfersulfatlösung eingetauchte Kupferelektrode. Beide Elektrolytlösungen werden von einer halbdurchlässigen (semipermeablen) Membran (Diaphragma) getrennt. Sie erlaubt nur den Konzentrationsausgleich zwischen den Sulfationen beider Lösungen.
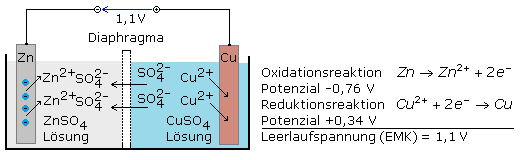
Befindet sich die Zelle im Leerlauf, stellt sich in beiden Elektrolyten ein Reaktionsgleichgewicht ein. Ein weiterer Stoffumsatz findet nicht statt. Wird der Stromkreis geschlossen, löst sich die Zinkelektrode (Anode) langsam auf und die Konzentration des gelösten Zinksulfats nimmt zu. Die freigesetzten Elektronen fließen im äußeren Stromkreis zur Kupferelektrode (Kathode) und reduzieren dort die in der Lösung vorhandenen Kupferionen. An der Elektrode scheidet sich aus der Kupfersulfatlösung metallisches Kupfer ab und die Kupfersulfatkonzentration der Halbzelle verringert sich. Als Spannungsquelle genutzt und mit einem Multimeter bestimmt ist die Kupferelektrode positiv und die Zinkelektrode negativ. Die unbelastete Quellen- oder Leerlaufspannung, früher als elektromotorische Kraft EMK bezeichnet, beträgt 1,1 Volt.
△Leclanché-Element
Um 1860 stellte der französische Chemiker Georges Leclanché eine Zink-Chlorid-Nasszelle zusammen. In ihrer ursprünglichen Art wird sie nicht mehr eingesetzt. Eine Zinkelektrode taucht in eine Lösung aus Ammoniumchlorid ein. Zink wird oxidiert und geht als Zinkchlorid in Lösung, wobei zwei Elektronen pro Zinkatom in der Zinkelektrode verbleiben. Die zweite Elektrode ist ein Kohlenstoff-Graphitstab, der nach einer Weiterentwicklung von Mangandioxid (Braunsteinpulver) als Depolarisator umgeben ist. Das Leclanché-Element erzeugt eine EMK von circa 1,5 Volt. Je nach Belastung laufen unterschiedliche Redoxreaktionen ab. Bei einer hohen Strombelastung entsteht ein unlöslicher Zinkkomplex, der die Nutzungsdauer der Zelle dauerhaft verkürzt. Bei geringerer Stromlast bildet sich Wasser, das den Transport der Ionen im Elektrolyten gewährleistet.
 △
△
Zink-Chlorid-Element
Das Zink-Chlorid-Element ist eine Weiterentwicklung der Leclanché-Nasszelle. Als Elektrolyt wird ein feuchtes Gel aus Zinkchlorid eingesetzt. Es ist auf Papierbahnen aufgestrichen und befindet sich zwischen dem Zinkbecher und der Graphit-Braunsteinelektrode. Der Braunstein Depolarisator verhindert die Bildung einer Wasserstoffelektrode am positiven Pol. Die Redoxreaktion bildet kein Wasser und verbessert so die Auslaufsicherheit des Elements.
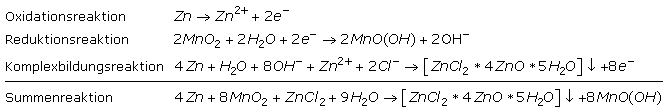 △
△
Zink-Braunstein-Trockenelement
Dieser Batterietyp basiert auf dem Leclanché-Element und war lange Zeit in Gebrauch. Nicht ganz korrekt als Zink-Kohle-Batterie bezeichnet. Der Zinkbecher bildet den Minuspol. Der Pluspol ist das Mangandioxid (Braunstein), mit dem der Graphitstab umhüllt ist. Zwischen Zinkbecher und Graphitstab befindet sich mit dem Elektrolyt getränktes Fließpapier. Er kann eine reine Lösung aus Ammoniumchlorid oder gemischt mit Zinkchlorid sein. Die Leerlaufspannung der Zelle beträgt 1,5 Volt.
Die Redoxreaktion entspricht der des Leclanché-Elements. Bei zu hoher Stromentnahme nimmt der Innenwiderstand durch den ausfallenden schwer löslichen Zinkdiamminchloridkomplex zu und die Zelle trocknet aus. Bei normaler Entladung bildet sich Wasser und die Zellen neigen mit dem Aufbrauchen des Zinkbechers zum Auslaufen.
△Alkali-Mangan-Element
Auch diese Primärzelle ist eine Weiterentwicklung des Leclanché-Elements mit einem anderen inneren Aufbau. Sie hat fast alle zuvor beschriebenen Typen abgelöst. Die eine Elektrode ist eine Paste aus reinem Zinkpulver in Kalilauge, bei der das Zink unter Abgabe von Elektronen oxidiert wird. Die Mischung ist in einer für Ionen durchlässigen Separatorfolie eingepackt und wird von der anderen Elektrode umgeben. Sie bildet einen äußeren Mantel aus synthetischem Mangandioxid, das unter Elektronenaufnahme reduziert wird und leitend mit dem Metallbecher umgeben ist. Im Elektrolyt übernehmen Hydroxidionen den Stromtransport. Die chemischen Prozesse in der Zelle sind infolge einiger Nebenreaktionen komplizierter. Der Vorteil der alkalischen Zelle ist die höhere Energiedichte und ein geringerer Innenwiderstand im Vergleich zu den sauren Zink-Mangandioxidzellen. Das folgende Bild zeigt den schematischen Aufbau beider Zink-Braunstein-Batterietypen.
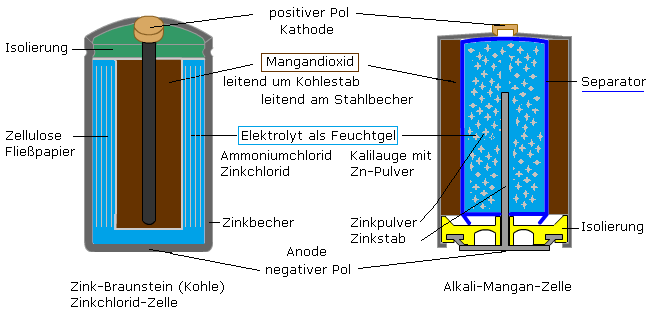
Im Zelleninneren laufen zusammengefasst einige chemische Reaktionen zur Gewinnung der elektrischen Energie ab. Die Hauptreaktionspartner sind das Zink, das zu Zinkionen oxidiert wird und Elektronen zur Verfügung stellt. Sie reduzieren bei geschlossenem Stromkreis die Mangan(IV)-Ionen im Braunstein zu Mangan(III)- und Mangan(II)-Ionen.
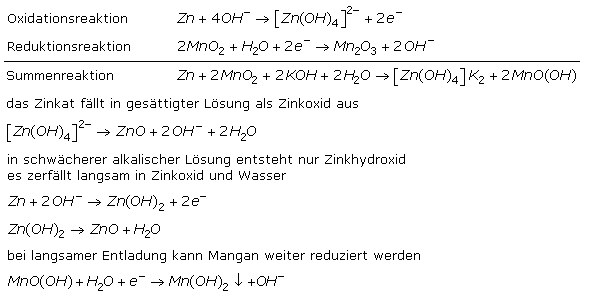
Vergleich der Eigenschaften
Beide Zellentypen haben im Neuzustand eine Leerlaufspannung von 1,5 Volt. Die Energiedichte der Alkali-Manganzelle ist mindestens doppelt so hoch wie die der Zink-Braunstein-Zellen. Der Innenwiderstand der Alkalizelle ist geringer und liegt unter 0,2 Ohm. Die sauren Zink-Braunstein-Zellen sind für hohe Kurzzeitbelastungen nicht geeignet, da ihre Zellenspannung dabei sehr schnell abnimmt. Bei den Alkalizellen nimmt die Zellenspannung bei allen Belastungen generell sehr viel langsamer ab. Die Selbstentladung der Alkalizelle ist mit rund 2,5% pro Jahr gering und die Lagerfähigkeit viel größer als die der sauren Zink-Kohle-Zellen. Die Auslaufsicherheit der Alkalimanganzellen ist wesentlich höher aber nicht 100%-ig. Die Spannung der entladenen Zelle liegt bei ≤1 Volt.
Regenerations- und Ladeschaltung
Grundsätzlich sind Primärzellen nicht auf- oder nachladbar. Die Redoxreaktionen bei äußerer Zufuhr elektrischer Energie nicht komplett umkehrbar. Die Industrie lieferte netzbetriebene mobile Audiogeräte mit Schaltungen zum Erhalt der Batterieladung aus. Im Netzbetrieb konnte damit der Batteriesatz teilweise regeneriert und so die Nutzungsdauer verlängert werden.
Eine geringe Wechselspannung wurde durch antiparallel geschaltete Dioden gleichgerichtet. Die positive und negative Gleichspannung wurde durch Widerstände im Strom begrenzt zur Regeneration der Batterien verwendet. Der Strom war mit rund 100 mA niedrig, wobei 4/5 als positiver Ladestrom und 1/5 als negativer Depolarisationsstrom die Gasentwicklung und Bildung kristalliner Reaktionsprodukte verhindern sollte. Gealterte oder weit entladene Zellen konnten damit nicht regeneriert werden.
△Knopfzellen
Der Name steht für die runde und flache Gehäuseform der Primärzellen, die ihre elektrische Energie durch ganz unterschiedliche Redoxsysteme erzeugen. Die Typbezeichnungen werden von einem Gremium für Normungen der International Electrotechnical Commission (IEC) bestimmt. Die beiden Kennbuchstaben charakterisieren das Redoxsystem. SR entspricht Zink-Silberoxid (Zn AgO), CR steht für Lithium-Manganoxid (Li MnO), LR für Alkali-Mangan und PR für Zink-Luft (Zn O). Von den folgenden vier Ziffern gibt das erste Paar den Durchmesser in mm und das zweite Paar die Zellendicke in 1/10 mm an. Decodiert bedeutet LR 2450 eine Alkali-Mangan-Zelle mit 24 mm Durchmesser und 5 mm Dicke.
Zink-Silberoxid-Zelle
Es ist eine Primärzelle, in der Bauform einer Knopfzelle für Uhren oder Geräte mit sehr geringem Strombedarf. Die Silberoxid-Zink-Zelle liefert eine Leerlaufspannung von 1,55 Volt und hält den Wert bei normaler Belastung bis kurz vor ihrer Entladung weitestgehend konstant. Die elektrische Energie liefert Zinkpulver und Silberoxid mit Kalilauge als Elektrolyt. Die Zelle hat eine hohe Energiedichte und ist nicht aufladbar.
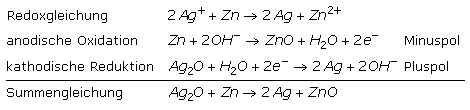 △
△